ИПТГ (изопропил-β-D-тиогалактозид) представляет собой аналог субстрата β-галактозидазы, обладающий высокой индуцируемостью.При индукции IPTG индуктор может образовывать комплекс с белком-репрессором, так что конформация белка-репрессора изменяется так, что он не может комбинироваться с целевым геном, и целевой ген экспрессируется эффективно.Так как же следует определять концентрацию ИПТГ во время эксперимента?Чем больше, тем лучше?
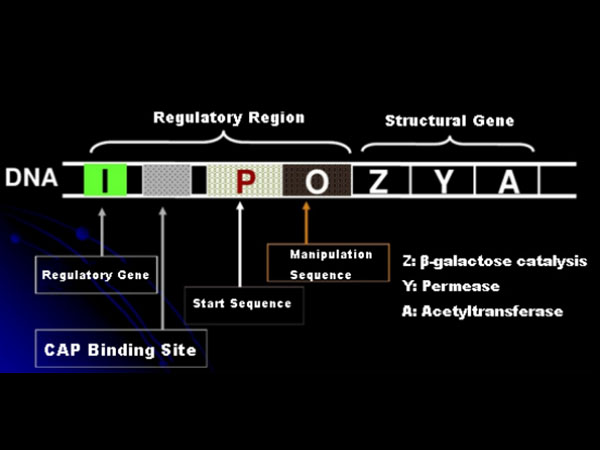
Во-первых, давайте поймем принцип индукции IPTG: лактозный оперон (элемент) E. coli содержит три структурных гена: Z, Y и A, которые кодируют β-галактозидазу, пермеазу и ацетилтрансферазу соответственно.lacZ гидролизует лактозу до глюкозы и галактозы или до аллокактозы;lacY позволяет лактозе из окружающей среды проходить через клеточную мембрану и проникать в клетку;lacA переносит ацетильную группу от ацетил-КоА к β-галактозиду, что предполагает устранение токсического эффекта.Кроме того, существует рабочая последовательность О, стартовая последовательность Р и регуляторный ген I. Код гена I представляет собой белок-репрессор, который может связываться с положением О операторной последовательности, так что оперон (мета) репрессируется и выключен.Существует также сайт связывания белка-активатора катаболического гена с сайтом связывания CAP выше инициирующей последовательности P. Последовательность P, последовательность O и сайт связывания CAP вместе составляют регуляторную область lac-оперона.Кодирующие гены трех ферментов регулируются одной и той же регуляторной областью для достижения скоординированной экспрессии генных продуктов.
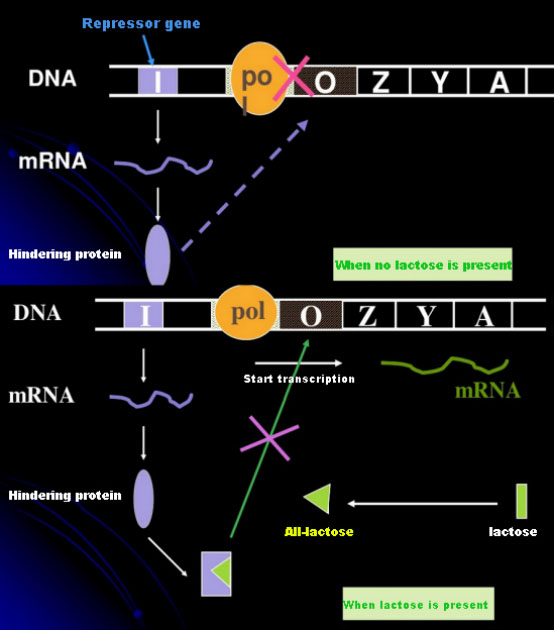
В отсутствие лактозы лак-оперон (мета) находится в состоянии репрессии.В это время lac-репрессор, экспрессируемый последовательностью I под контролем последовательности промотора PI, связывается с последовательностью О, что предотвращает связывание РНК-полимеразы с последовательностью P и ингибирует инициацию транскрипции;когда присутствует лактоза, может индуцироваться лактоза (мета). В этой системе оперонов (мета) настоящим индуктором не является сама лактоза.Лактоза поступает в клетку и катализируется β-галактозидазой, превращаясь в аллолактозу.Последняя, как молекула-индуктор, связывается с белком-репрессором и изменяет конформацию белка, что приводит к диссоциации белка-репрессора от О-последовательности и транскрипции.Изопропилтиогалактозид (ИПТГ) оказывает тот же эффект, что и аллолактоза.Это очень мощный индуктор, который не метаболизируется бактериями и очень стабилен, поэтому широко используется в лабораториях.
Как определить оптимальную концентрацию ИПТГ?Возьмем, к примеру, кишечную палочку.
Генно-инженерный штамм E. coli BL21, содержащий положительный рекомбинантный pGEX (CGRP/msCT), инокулировали в жидкую среду LB, содержащую 50 мкг·мл-1 ампер, и культивировали в течение ночи при 37°C.Вышеуказанную культуру инокулировали в 10 флаконов со свежей жидкой средой LB объемом 50 мл, содержащей 50 мкг·мл-1 ампер в соотношении 1:100 для размножающейся культуры, и когда значение OD600 составляло 0,6-0,8, добавляли IPTG до конечной концентрации.Это 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 ммоль·л-1.После индукции при той же температуре и в то же время из него отбирали 1 мл бактериального раствора, собирали бактериальные клетки центрифугированием и подвергали SDS-PAGE для анализа влияния различных концентраций ИПТГ на экспрессию белка, а затем выберите концентрацию IPTG с наибольшей экспрессией белка.
После экспериментов окажется, что концентрация ИПТГ не настолько велика, насколько это возможно.Это связано с тем, что IPTG обладает определенной токсичностью для бактерий.Превышение концентрации также приведет к гибели клетки;и вообще говоря, мы надеемся, что чем больше растворимого белка экспрессируется в клетке, тем лучше, но во многих случаях, когда концентрация IPTG слишком высока, будет образовываться большое количество включений.Организм, но количество растворимого белка уменьшилось.Следовательно, наиболее подходящей концентрацией IPTG часто является не чем больше, тем лучше, а чем ниже концентрация.
Целью индукции и культивирования генно-инженерных штаммов является повышение выхода целевого белка и снижение затрат.На экспрессию целевого гена влияют не только собственные факторы штамма и экспрессирующая плазмида, но и другие внешние условия, такие как концентрация индуктора, температура индукции и время индукции.Поэтому, как правило, прежде чем неизвестный белок будет экспрессирован и очищен, лучше всего изучить время индукции, температуру и концентрацию ИПТГ, чтобы выбрать подходящие условия и получить наилучшие экспериментальные результаты.
Время публикации: 31 декабря 2021 г.

